Introducción al marcado CE de producto sanitario sin finalidad médica
Extracto de la intervención del experto Rubén Martínez, Business Manager de CERE Medical en Beauty Contact Madrid, acerca del nuevo Reglamento Europeo en la materia
-
Un posible nuevo ritual de belleza
-
Innovación, conocimiento y negocio se dan cita en Nutraceuticals Europe 2026
Nutraceuticals Europe 2026 reunirá en Ifema Madrid a la industria internacional de ingredientes funcionales en dos jornadas dedicadas a la innovación, el conocimiento y el negocio
-
Glosario Cosmetología Actual
Un práctico repaso a los términos que definen la cosmetología actual
-
La nueva ley de aparatología avanzada en los centros de estética
Muchas son las dudas todavía por parte de profesionales, alumnos y empresas fabricantes y distribuidoras de la estética acerca de la nueva ley de la UE que entrara en vigor en 2021. Resumimos y contestamos a tus preguntas en el siguiente artículo
-
CONCURSO BEAUTY MARKET ESTÉTICA
Beauty Market y mesoestetic® regalan 6 packs de productos mesoprotech®, protección solar de amplio espectro y máxima eficacia
Tecnologías avanzadas y nuevos formatos que facilitan la aplicación y maximizan la eficacia de sus productos
Rubén Martínez, Business Manager CERE Medical, la División especializada en el servicio completo de Ensayos, Certificación, Inspección y Verificación de normas para el Marcado CE y requisitos de todos los países cubiertos por el Esquema IECEE, ha protagonizado en Beauty Contact Madrid, una mesa donde se ha expuesto desde el punto de vista tanto de la propia certificación como de la formación, el estado actual de la nueva ley de la UE de aparatología avanzada en los centros de estética.
Rubén Martínez, no obstante, volverá a revisar el estado de dicha ley, que despierta muchas dudas y también desconocimiento al sector, sujeta a aprobaciones pendientes por parte del órgano legislador, en Beauty Contact País Vasco-Bilbao, que va a tener lugar los días 5 y 6 de junio en el Hotel Occidental.
El experto, en su intervención, revisó los aspectos legislativos y de contención en lo referido a aparatología estética. Junto a él intervino Macarena Sanahuja, gerente de Tevían, quien por su parte se centró en las consecuencias para los centros de estética, desde el punto de vista de la certificación y que publicaremos en los próximos días en nuestras páginas.
¿Qué es CERE?
Antes de empezar, revisamos qué es CERE y cuál es su labor y objetivos:
• CERE fue fundada en 2015. Dispone de un equipo 45 personas entre direcciones técnicas, auditores, técnicos analistas de ensayos en todos los niveles, inspectores, administración y comercial.
• Contamos con más de 50 años de experiencia acumulada en ensayos, simulación y certificación para todas sus áreas de negocio.
• CERE es Entidad de Certificación y Laboratorio de Ensayos de Producto.
• CERE es Organismo Notificado (NCB) del esquema CB acreditado por IECEE.
• Es participante activo en los principales comités de normalización del sector.
• CERE es la primera entidad española reconocida por FDA (Food and Drug Administration) en el programa ASCA (Accreditation Scheme for Conformity Assessment). CERE se posiciona como uno de los 4 laboratorios europeo de referencia en el programa.
A partir de aquí, entramos en materia, y tal y como hemos anunciado, reproducimos un extracto de la ponencia de Rubén Martínez para información de nuestros lectores.
1.- Legislación en ámbito Marcado CE
» Legislación Europea:
• Reglamento:
Norma emanada de los órganos de la Unión Europea directamente aplicable en los Estados miembros, sin necesidad de trasposición.
• Directiva:
En la Unión Europea, norma que fija a los Estados los objetivos que en determinada materia han de alcanzar, reservándoles la facultad de decidir sobre la forma y los medios de conseguirlos.
• Decreto:
Decisión de un gobernante o de una autoridad, o de un tribunal o juez, sobre la materia o negocio en que tengan competencia.
• Norma:
Regla que se debe seguir o a que se deben ajustar las conductas, tareas, actividades, etc.
REGLAMENTO PRODUCTO SANITARIO 2017/745.
Qué: todo instrumento, dispositivo, equipo, programa informático, implante, reactivo, material u otro articulo destinado por el fabricante a ser utilizado en personas, por separado o en combinación, con alguno de los siguientes fines médicos específicos.
Para: diagnóstico, prevención, seguimiento, predicción, pronostico, control, tratamiento o alivio de una enfermedad.
Diagnóstico, seguimiento, tratamiento, alivio o compensación de una lesión o de una discapacidad.
Investigación, sustitución o modificación de la anatomía o de un proceso fisiológico o patológico.
Obtención de información mediante el examen in vitro de muestras procedentes del cuerpo humano, incluyendo donaciones de órganos, sangre y tejidos, y que no ejerza la acción principal prevista en el interior o en la superficie del cuerpo humano por mecanismos farmacológicos, inmunológicos ni metabólicos, pero a cuya función puedan contribuir tales mecanismos.
Los siguientes productos también se consideran productos sanitarios:
- Los productos de control o apoyo a la concepción.
- Los productos destinados específicamente a la limpieza, desinfección o esterilización de los productos que se contemplan en el articulo 1, apartado 4 (PS, accesorios y Productos ANEXO XVI) y el párrafo primer del presente punto.
ANEXO XVI. LISTA DE GRUPOS DE PRODUCTOS SIN FINALIDAD MÉDICA PREVISTA A LOS QUE SE REFIERE EL ARTÍCULO 1, APARTADO 2
1. Lentes de contacto u otros artículos destinados a ser introducidos o colocados en el ojo.
2. Productos destinados a ser total o parcialmente introducidos en el cuerpo humano mediante medios invasivos de tipo
quirúrgico a efectos de modificación de la anatomía o fijación de partes del cuerpo, con excepción de los productos para
tatuajes y piercings.
3. Sustancias, combinaciones de sustancias o artículos destinados a su uso como relleno facial o en otras zonas dérmicas o de membranas mucosas mediante inyección subcutánea, submucosa o intradérmica o con otros medios de introducción, excluidos los destinados al tatuaje.
4. Equipos destinados a usarse para reducir, retirar o destruir tejido adiposo, como los equipos para liposucción, lipólisis o lipoplastia.
5. Equipos que emiten radiación electromagnética de alta intensidad (por ejemplo, infrarrojos, luz visible y ultravioleta) destinados a su uso en el cuerpo humano, con inclusión de fuentes coherentes y no coherentes, monocromáticas o de amplio espectro, tales como láseres y equipos de luz pulsada intensa para rejuvenecimiento de la piel, eliminación de tatuajes, depilación u otros tratamientos dérmicos.
6. Equipos destinados a la estimulación cerebral que aplican corrientes eléctricas o campos magnéticos o electromagnéticos
que penetran en el cráneo para modificar la actividad neuronal del cerebro.
2.- Esquemas de Certificación
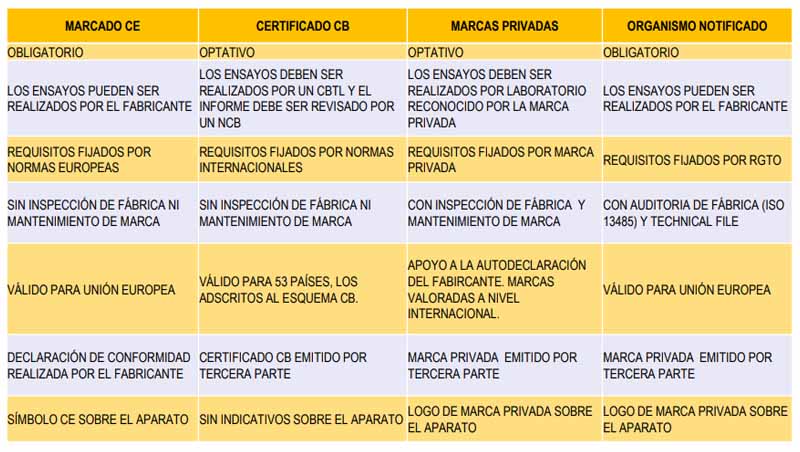
3.- Marcado CE
¿Qué significa el marcado CE sobre un producto?
Compromiso del fabricante ante los compradores, usuarios, consumidores (producto de consumo), y las autoridades mediante el que certifica que el producto es conforme con los requisitos esenciales de todas las Directivas de Nuevo Enfoque que le sean de aplicación al mismo.
¿Qué significa el marcado CE sobre un producto?
Desde 1992: elimina todas las Marcas Nacionales
PROCEDIMIENTOS EVALUACIÓN DE CONFORMIDAD.
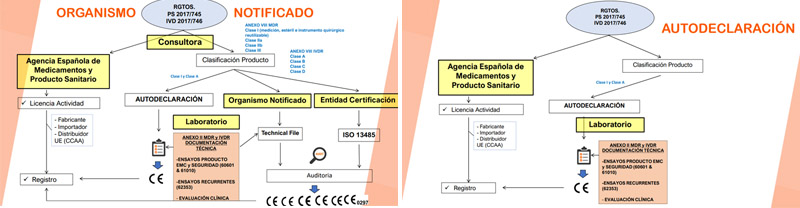
4.- Anexo XVI Borrador
» ANEXO II, se refiere al Grupo 1: el presente anexo se aplica a las lentes de contacto enumeradas en la sección 1 del anexo XVI del Reglamento (UE) 2017/745. Las lentes de contacto que contienen herramientas, como una antena o un microchip, las lentes de contacto que son dispositivos activos y otros artículos destinados a ser introducidos en el ojo o sobre él no están cubiertos por el presente anexo.
Lentes de contacto.
» ANEXO III, se refiere al Grupo 2: el presente anexo se aplica a los productos destinados a ser introducidos total o parcialmente en el cuerpo humano por medios quirúrgicamente invasivos con el fin de modificar la anatomía, enumerados en la sección 2 del anexo XVI del Reglamento (UE) 2017/745. Los productos de tatuaje, los piercings y los productos destinados a ser introducidos total o parcialmente en el cuerpo humano a través de medios quirúrgicamente invasivos con el fin de modificar la fijación de partes del cuerpo no están cubiertos por el presente anexo. El presente anexo no se aplica a los
productos implantables activos.
Prótesis estéticas.
» ANEXO IV, se refiere al Grupo 3: el presente anexo se aplica a las sustancias, combinaciones de sustancias o artículos destinados a ser utilizados para el relleno facial o de otras membranas dérmicas o mucosas mediante inyección subcutánea, submucosa o intradérmica u otro tipo de introducción, excluidos los destinados al tatuaje, enumerados en la sección 3 del anexo XVI del Reglamento (UE) 2017/745. El presente anexo solo se aplica a los medios de introducción en el cuerpo, por ejemplo, jeringas y dermarollers, cuando están precargados con las sustancias, combinaciones de sustancias u otros elementos enumerados en la sección 3 del anexo XVI del Reglamento (UE) 2017/745. Este anexo no se aplica a los productos activos..
Ácido Hialurónico.
» ANEXO V, se refiere al Grupo 4: el presente anexo se aplica a los equipos destinados a ser utilizados para reducir, eliminar o destruir el tejido adiposo, como los equipos de liposucción, lipólisis o lipoplastia, enumerados en la sección 4 del anexo XVI del Reglamento (UE) 2017/745. El presente anexo no se aplica a los productos implantables activos.
(1) "liposucción": la eliminación quirúrgica de los depósitos de grasa subcutánea localizada por aspiración;
(2) "productos para la liposucción": productos destinados por el fabricante a ser utilizados para la liposucción;
(3) "lipólisis": la destrucción localizada de los depósitos de grasa;
(4) "productos de lipólisis": los productos destinados por el fabricante a ser utilizados con fines de lipólisis;
(5) "lipoplastia": la modificación del contorno corporal mediante la eliminación del exceso de grasa;
(6) "productos para lipoplastia": los productos destinados por el fabricante a ser utilizados para la lipoplastia.
EQUIPOS DE SUCCIÓN, ELÉCTROESTIMULACIÓN, RADIOFRECUENCIA, LASER, ULTRASONIDO, CAVITACIÓN, PRESOTERAPIA...
- UNE-EN 60601-2-2:2010 equipos quirúrgicos de alta frecuencia y de los accesorios quirúrgicos de alta frecuencia.
- UNE-EN 60601-2-3:2015 equipos terapéuticos de onda corta.
- UNE-EN 60601-2-5:2016 equipos de fisioterapia por ultrasonidos.
- UNE-EN 60601-2-10:2015 estimuladores de nervios y de músculos.
- UNE-EN 60601-2-62:2015 ultrasonidos de alta intensidad con fines terapéuticos. (HITU).
- UNE-EN ISO 10079-1:2016 Equipo médico de aspiración. Parte 1: Equipo de aspiración eléctrico.

» ANEXO VI, se refiere al Grupo 5: el presente anexo se aplica a los equipos emisores de radiación electromagnética de alta intensidad (por ejemplo, infrarrojos, luz visible y ultravioleta) destinados a ser utilizados en el cuerpo humano, incluidas las fuentes coherentes y no coherentes, monocromáticas y de amplio espectro, como los láseres y los equipos de luz pulsada intensa, para el rejuvenecimiento de la piel, la eliminación de tatuajes o del vello u otros tratamientos cutáneos, enumerados en la sección 5 del anexo XVI del Reglamento (UE) 2017/745.
A efectos del presente anexo, otros tratamientos de la piel incluyen el tratamiento no médico de losnevos flamígeros, los hemangiomas, las telangiectasias, las arañas vasculares, las zonas de pielpigmentada y las cicatrices que no son lesiones en el sentido del artículo 2, punto 1, segundo guión,del Reglamento (UE) 2017/745. Por ejemplo, el presente anexo se aplica a los productos destinados a tratar las cicatrices del acné, pero no se aplica a los productos para otros tratamientos del acné.
El presente anexo no se aplica a los equipos que utilizan radiación óptica infrarroja para calentar el cuerpo o partes del cuerpo ni a las camas solares.
EQUIPOS DE LÁSER E IPL...
- UNE-EN 60601-2-22:2013 equipos láser quirúrgicos, terapéuticos y de diagnostico.
- UNE-EN 60825-1:2015 Seguridad de los productos láser. Parte 1: Clasificación de los equipos y requisitos.
- UNE-EN 60601-2-57:2012 fuente luminosa no es un láser utilizados para uso terapéutico, diagnóstico, monitorización y cosmética/estética.
- UNE-EN 60601-2-83:2020 equipo doméstico de terapia por luz.
» ANEXO VII, se refiere al Grupo 6: el presente anexo se aplica a los equipos destinados a la estimulación cerebral que aplican corrientes eléctricas o campos magnéticos o electromagnéticos que penetran en el cráneo para modificar la actividad neuronal en el cerebro, tal como se enumeran en la sección 6 del anexo XVI del Reglamento (UE) 2017/745. Dichos equipos incluyen dispositivos de estimulación transcraneal de corriente alterna, estimulación transcraneal de corriente continua, estimulación magnética transcraneal y estimulación transcraneal de ruido aleatorio. Este anexo no se aplica a los dispositivos invasivos.
tDCS: Estimulación Transcraneal por Corriente Directa.
- UNE-EN IEC 80601-2-26:2020 electroencefalogramas.
- UNE-EN 60601-2-40:2019 electromiógrafos y equipos de respuesta evocada.
5.- Formación.
» RESPONSABLE TECNICO FABRICANTE DE PRODUCTO SANITARIO.
Titulación del responsable técnico.
La idoneidad de la titulación del responsable técnico será valorada por la AEMPS de forma individualizada. A tal efecto, la empresa solicitante aportará la documentación que permita acreditar la cualificación del técnico propuesto en relación con los productos de que se trate (título universitario, estudios complementarios, experiencia laboral, etc.).
En el caso de fabricación en serie, agrupación y esterilización, el responsable técnico deberá contar, imprescindiblemente, con titulación universitaria que acredite su cualificación en los productos que tenga a su cargo. Esta titulación también se exigirá en caso de importación, con independencia, de que los productos importados sean de fabricación seriada o a medida.
De forma general, se considerarán apropiadas las titulaciones universitarias específicas relacionadas con los productos y, en su ausencia, las titulaciones universitarias sanitarias o relacionadas con la tecnología de fabricación de los mismos, completadas, en su caso, con formación específica en los productos.
En el caso de fabricación a medida de prótesis dentales, el responsable técnico deberá ser protésico dental en cumplimiento de la legislación reguladora de dicha profesión.
En el caso de fabricación a medida en el sector de la ortopedia, se tendrá en cuenta lo establecido en la Disposición final primera del Real Decreto 1591/2009, de 16 de octubre.

Recomendamos